製品情報
- 添付文書
 (458KB)第3版 2025年10月
(458KB)第3版 2025年10月 - インタビューフォーム
 (1.1MB)
(1.1MB) - 各種コード一覧

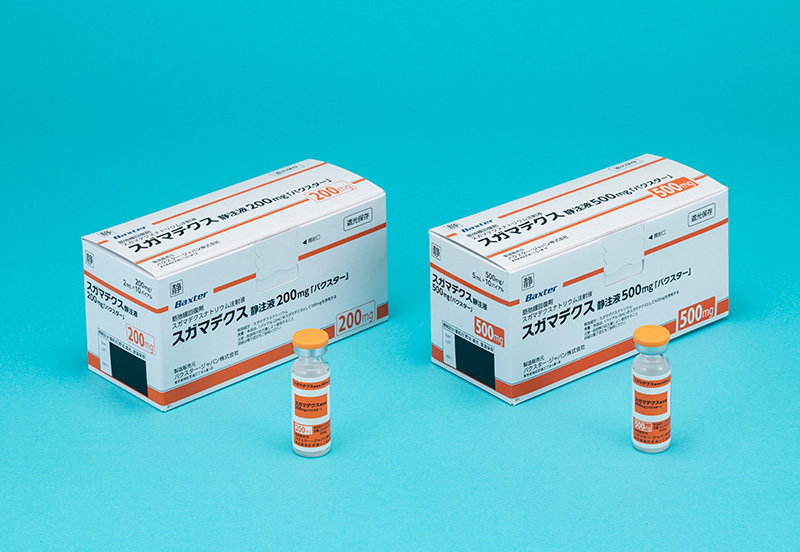
- 製剤・製品写真

- 光安定性試験
 (144KB)
(144KB)
関連情報
|
製品名 |
規格 |
包装 |
規制区分 |
承認番号 |
|---|---|---|---|---|
|
スガマデクス静注液200㎎「バクスター」 |
2mL |
1バイアル(2mL)×10 |
処方箋医薬品 |
30600AMX00069000 |
|
スガマデクス静注液500㎎「バクスター」 |
5mL |
1バイアル(5mL)×10 |
処方箋医薬品 |
30600AMX00070000 |
|
一般名 |
薬効分類 |
貯法 |
有効期間 |
バイアルサイズ(約) |
箱サイズ(約) |
|---|---|---|---|---|---|
|
スガマデクスナトリウム |
筋弛緩回復剤 |
室温保存 |
3年 |
高さ53mm × |
高さ65mm × 横幅129mm × |
安定供給確保への取り組み
本剤は世界10カ国以上の国々で販売をしています。
増産計画できるようにバイアル形状は世界各国と標準化し安定供給ができるよう取り組んでいます。
【後発品の安定供給に関連する情報の公表等に関するガイドラインより、一部抜粋*】
- 原薬の製造国:スペイン
- 共同開発情報:単独開発
- 余剰製造能力(製造余力)の種類:安定供給のための予備対応力の確保にあたっては、有事に備えて、平時から柔軟かつ迅速な増産が可能なように下記の製造体制(製造余力)を整えております。
- 生産ロット数を増加
- 大スケール製造設備への切り替え
*「後発医薬品の安定供給に関連する情報の公表等に関するガイドライン」に沿って、随時情報公開をさせていただきます。
 日本の承認内容に基づき日本国内で使用される製品の情報です。 |
日本の承認内容に基づき日本国内で使用される製品の情報です。 | 